- Millised on termodünaamika seadused?
- Termodünaamika seaduste päritolu
- Termodünaamika esimene seadus
- Termodünaamika teine seadus
- Termodünaamika kolmas seadus
- Termodünaamika nullseadus
Selgitame, millised on termodünaamika seadused, mis on nende põhimõtete päritolu ja igaühe põhiomadused.

Millised on termodünaamika seadused?
Termodünaamika seadused (või termodünaamika põhimõtted) kirjeldavad kolme füüsikalise fundamentaalse suuruse käitumist temperatuuri, Energia jaentroopia, mis iseloomustavad termodünaamilisi süsteeme. Termin "termodünaamika" pärineb kreeka keelest termos, Mida see tähendab "soojust", Y dünamo, Mida see tähendab "jõudu”.
Matemaatiliselt kirjeldab neid põhimõtteid a seatud võrrandid, mis selgitavad termodünaamiliste süsteemide käitumist, mis on määratletud kui mis tahes uurimisobjekt (alates a molekul või a inimene, kuni õhkkond või keev vesi kastrulis).
Termodünaamikal on neli seadust ja need on füüsikaliste seaduste mõistmiseks üliolulised universum ja teatud nähtuste, nagu näiteks liikumine igavene.
Termodünaamika seaduste päritolu
Neli põhimõtet termodünaamika Need on erineva päritoluga ja mõned on sõnastatud eelmistest. Esimene, mis loodi, oli tegelikult teine, prantsuse füüsiku ja inseneri Nicolás Léonard Sadi Carnot’ töö 1824. aastal.
Kuid 1860. aastal sõnastasid selle põhimõtte uuesti Rudolf Clausius ja William Thompson, lisades seejärel selle, mida me praegu nimetame termodünaamika esimeseks seaduseks. Hiljem ilmus kolmas, tuntud ka kui "Nersti postulaat", kuna see tekkis tänu Walther Nernsti uuringutele aastatel 1906–1912.
Lõpuks ilmus 1930. aastal nn nullseadus, mille pakkusid välja Guggenheim ja Fowler. Tuleb öelda, et mitte kõigis valdkondades ei tunnistata seda tõeliseks seaduseks.
Termodünaamika esimene seadus

Esimest seadust nimetatakse "energia jäävuse seaduseks", kuna see dikteerib seda igal juhul süsteem Keskkonnast eraldatuna on energia koguhulk alati sama, kuigi seda saab muundada ühest energialiigist erinevateks. Ehk teisisõnu: energiat ei saa luua ega hävitada, vaid ainult transformeerida.
Seega, kui anda füüsilisele süsteemile teatud kogus soojust (Q), saab selle energia koguhulga arvutada tarnitud soojuse miinustöö (W), mida süsteem oma ümbruses teostab. Väljendatuna valemis: ΔU = Q - W.
Selle seaduse näitena kujutame ette lennukimootorit. See on termodünaamiline süsteem, mis koosneb kütusest, mis reageerib protsessi käigus keemiliselt põlemine, eraldab soojust ja teeb tööd (mis paneb lennuki liikuma). Seega: kui saaks mõõta tehtud töö hulka ja eraldunud soojust, saaksime arvutada süsteemi koguenergia ja järeldada, et energia mootoris püsis lennu ajal konstantsena: energiat ei tekkinud ega hävinud, pigem muudeti seda. kohta keemiline energia juurde kalorienergia YKineetiline energia (liikumine, see tähendab töö).
Termodünaamika teine seadus
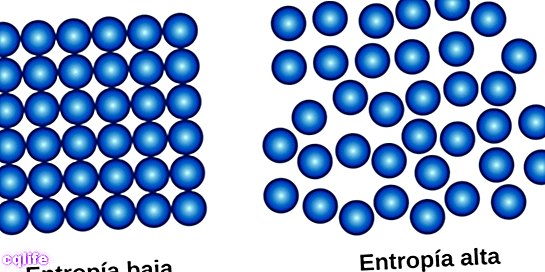
Teise seaduse, mida nimetatakse ka "entroopia seaduseks", võib kokku võtta nii, et kogus entroopia universumis kipub suurenema ilm. See tähendab, et süsteemide korrastamatuse aste suureneb kuni saavutatakse tasakaalupunkt, mis on süsteemi suurima korratuse seisund.
See seadus tutvustab füüsikas fundamentaalset mõistet: entroopia mõistet (tähistatakse tähega S), mis füüsikaliste süsteemide puhul tähistab korratuse astet. Selgub, et igas füüsilises protsessis, milles toimub energia muundumine, ei ole teatud hulk energiat kasutatav ehk ei saa tööd teha. Kui tööd teha ei saa, on enamasti selleks energiaks soojus. See soojus, mida süsteem vabastab, suurendab süsteemi häireid, selle entroopiat. Entroopia on süsteemi häire mõõt.
Selle seaduse sõnastus näeb ette, et entroopia muutus (dS) on alati võrdne või suurem kuisoojusülekanne (dQ), jagatud süsteemi temperatuuriga (T). See tähendab, et: dS ≥ dQ / T.
Et seda näite abil mõista, piisab, kui põletada teatud kogus asja ja seejärel koguge saadud tuhk kokku. Nende kaalumisel veendume, et see on vähem ainet kui algses olekus: osa ainest muudeti soojuseks gaasid et nad ei saa süsteemi kallal tööd teha ja aitavad kaasa selle häirele.
Termodünaamika kolmas seadus

Kolmas seadus ütleb, et süsteemi entroopia, mis on viidud absoluutse nullini, on kindel konstant. Teisisõnu:
- Absoluutse nullini (kelvini ühikutes null) jõudmisel füüsiliste süsteemide protsessid peatuvad.
- Absoluutse nulli (kelvini ühikutes null) saavutamisel on entroopial konstantne minimaalne väärtus.
Nn absoluutse nullini (-273,15 ° C) on igapäevaselt raske jõuda, kuid sügavkülmas toimuvat analüüsides võime sellele seadusele mõelda: toit et sinna ladestume, läheb nii külmaks, et selle sees toimuvad biokeemilised protsessid aeglustuvad või isegi peatuvad. Sellepärast selle lagunemine viibib ja selle tarbimist palju kauemaks.
Termodünaamika nullseadus
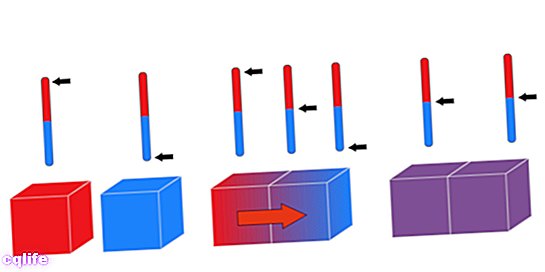
Nullseadust tuntakse selle nime all, kuigi see kehtis viimasena. Tuntud ka kui Termilise tasakaalu seadus, näeb see põhimõte ette, et: "Kui kaks süsteemi on sees termiline tasakaal sõltumatult kolmanda süsteemiga peavad need olema ka omavahel termilises tasakaalus. Seda saab loogiliselt väljendada järgmiselt: kui A = C ja B = C, siis A = B.
See seadus võimaldab võrrelda kolme erineva keha A, B ja C soojusenergiat. Kui keha A on kehaga C termilises tasakaalus (neil on sama temperatuur) ja ka B-l on sama temperatuur kui C, siis A ja C. B on sama temperatuuriga.
Teine viis selle põhimõtte väljendamiseks on väita, et kui kaks erineva temperatuuriga keha puutuvad kokku, vahetavad nad soojust, kuni nende temperatuur ühtlustub.
Selle seaduse igapäevaseid näiteid on lihtne leida. Kui satume külma või kuuma vette, märkame temperatuuri erinevust alles esimestel minutitel, kuna siis jõuab meie keha termilise tasakaalu veeni.Vesi ja me ei märka enam erinevust. Sama juhtub siis, kui siseneme kuuma või külma ruumi: alguses märkame temperatuuri, kuid siis lakkame erinevuse tajumisest, sest jõuame sellega termilisesse tasakaalu.
